※本記事は2021年1月6日時点の情報をもとにまとめられたものです。
2019年12月末に新型コロナウイルスが中国武漢で発生してから、1年以上が経過した。当初は新興感染症であったことから、感染経路や臨床経過などが不明であり、感染予防や治療方針の決定に難渋した。しかし、この1年間に、新型コロナウイルスに関する知見が集積され、ワクチン接種も始まりつつある。ここでは新型コロナウイルス感染者のトリアージとワクチンについて解説する。
トリアージ
「病院や診療所に発熱患者が受診した場合はどうすればよいか?」「新型コロナウイルス感染者をどのようにトリアージすればよいか?」などという疑問を持つ医療従事者は多い。実際、発熱、咳、倦怠感がみられる人が受診した場合には新型コロナウイルス感染症も疑うことになる。そのため、医療機関などの玄関には発熱の有無を測定する機器が置かれ、発熱患者を施設内に入れないような対策を取ってきた。
しかし、新型コロナウイルスに感染した人の40%以上が無症状のことがあり1)、「発症前の感染者(感染を伝播した時点では症状がないが、後で症状を経験する人)」および「無症候性感染者(症状を経験したことがない感染者)」からの感染が、すべての感染の50%以上を占めるという報告もある1,2,3)。症状が全くみられない感染者をトリアージすることはできない。実際、医療現場では「交通事故にて救急搬入された患者が感染していた」「鉄棒から落下して骨折した生徒が感染していた」などという報告を聞くことがある。
来院した患者が感染しているか否かの判断はRT-PCR検査もしくは抗原定量検査を参考にするしかない。仮に、すべての患者の検査ができたとしても、「結果が陰性である=感染していない」ということにはならない。RT-PCR検査と言えども100%の検査ではないからである。そのため、「すべての患者は新型コロナウイルスに感染しているかもしれない」という前提で対応することが適切である。
発熱外来や救急外来などで新型コロナウイルス感染者をトリアージすることは困難である。むしろ、トリアージにて「感染していない」と判断されることによって、油断が生じる危険性がある。そのため、患者も医療従事者もマスクを常に着用し、手指消毒も確実に実施することが大切である。そして、患者の飛沫が眼粘膜に飛散する可能性があるならば、医療従事者はアイシールドやゴーグルを着用して感染対策を強化する必要がある。
ワクチン
1798年、イギリスの医師ジェンナーが種痘の有効性を報告してから、種痘は世界に広まり、天然痘は撲滅された。しかし、種痘という新しい予防手段に対して、「種痘をすれば牛になる」などと言う非科学的な恐怖によって、接種を辞退する人々も多くいた。新型コロナウイルスの世界的な流行下で、多くの企業や研究機関が過去に見られないスピードでワクチンを開発した。多大な努力によって勝ち得たワクチンを非科学的な恐怖(「ウイルスの遺伝子が自分の遺伝子に入り込み、子孫が危うくなる」など)によって、不十分な接種率になることは是非とも避けたい。特に、感染することによって重症化する高齢者や基礎疾患のある人々では高い接種率を獲得すべきである。そのためには、医療側は一般市民に向けて正しい情報を提供する必要がある。特に、彼らが「どのタイプのワクチンが接種されるのか?その有効性はどの程度か?」「副反応にはどのようなものがあるのか?」などを理解することは接種率の向上につながる。
新型コロナウイルスワクチン
新型コロナウイルスの表面にはスパイク蛋白質が存在する。それによって宿主細胞のウイルス受容体(アンギオテンシン転換酵素2)に結合して、細胞内に侵入していく。このスパイク蛋白質に対する抗体はウイルスの宿主細胞への接着を阻害し、ウイルスを中和する。そのため、スパイク蛋白質がワクチン開発の標的となっている。
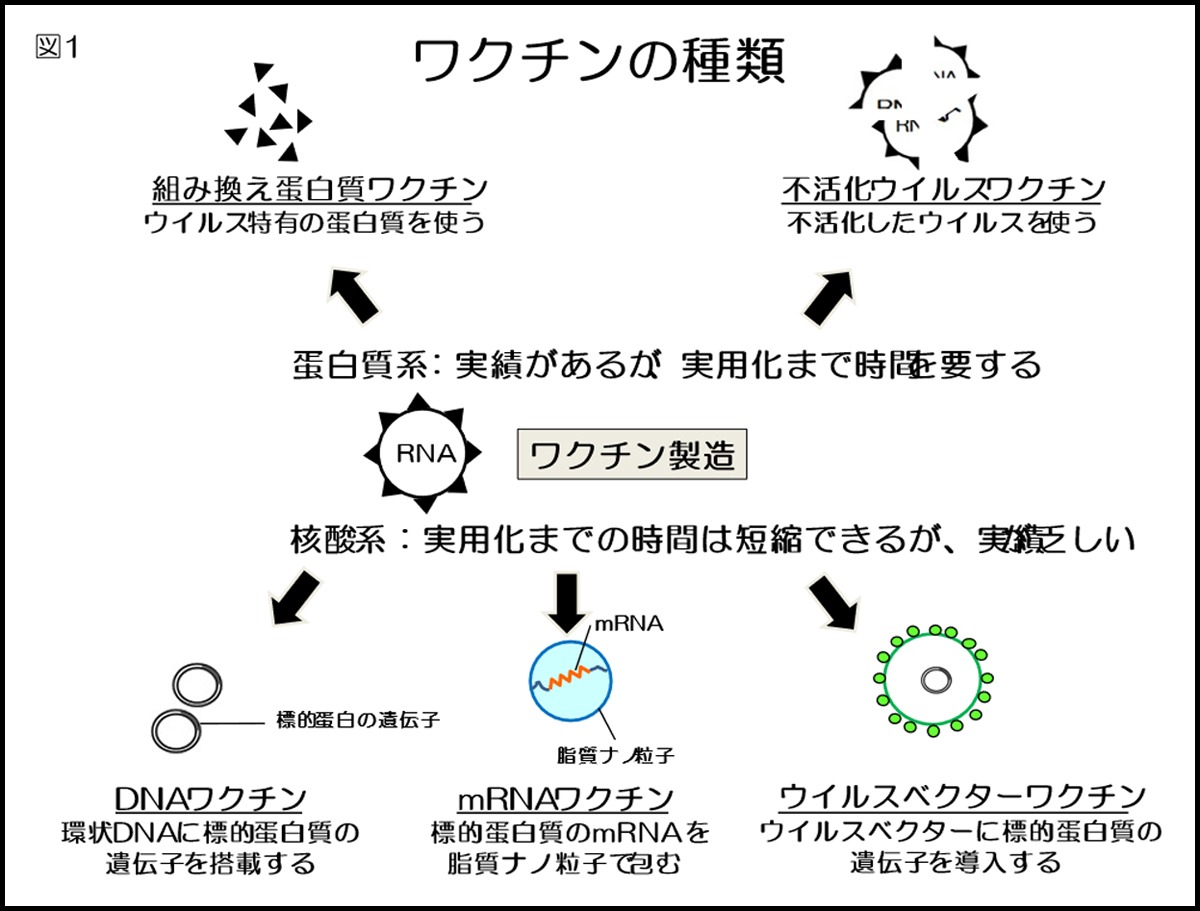
ワクチンは大きく分けて、「蛋白質系」と「核酸系」がある(図1)。蛋白質系ワクチンには「組み換え蛋白質ワクチン」および「不活化ウイルスワクチン」がある。組み換え蛋白質ワクチンにはヒトパピローマウイルスワクチンなどがあり、不活化ワクチンとしてはインフルエンザワクチンなどが使用されている。蛋白質系ワクチンには実績はあるが、臨床応用するまでに要する時間が長いという問題がある。
核酸系ワクチンには「DNAワクチン」「mRNAワクチン」「ウイルスベクターワクチン」がある。ウイルスベクターワクチンにはエボラウイルスワクチンなどの経験はあるものの、DNAワクチンおよびmRNAワクチンが人間に使用されたことはない。これらの核酸系ワクチンは迅速に実用化できる利点があるが、臨床での実績が乏しい。現在、日本において接種が始まろうとしているワクチンはmRNAワクチンとウイルスベクターワクチンである。
mRNAワクチン
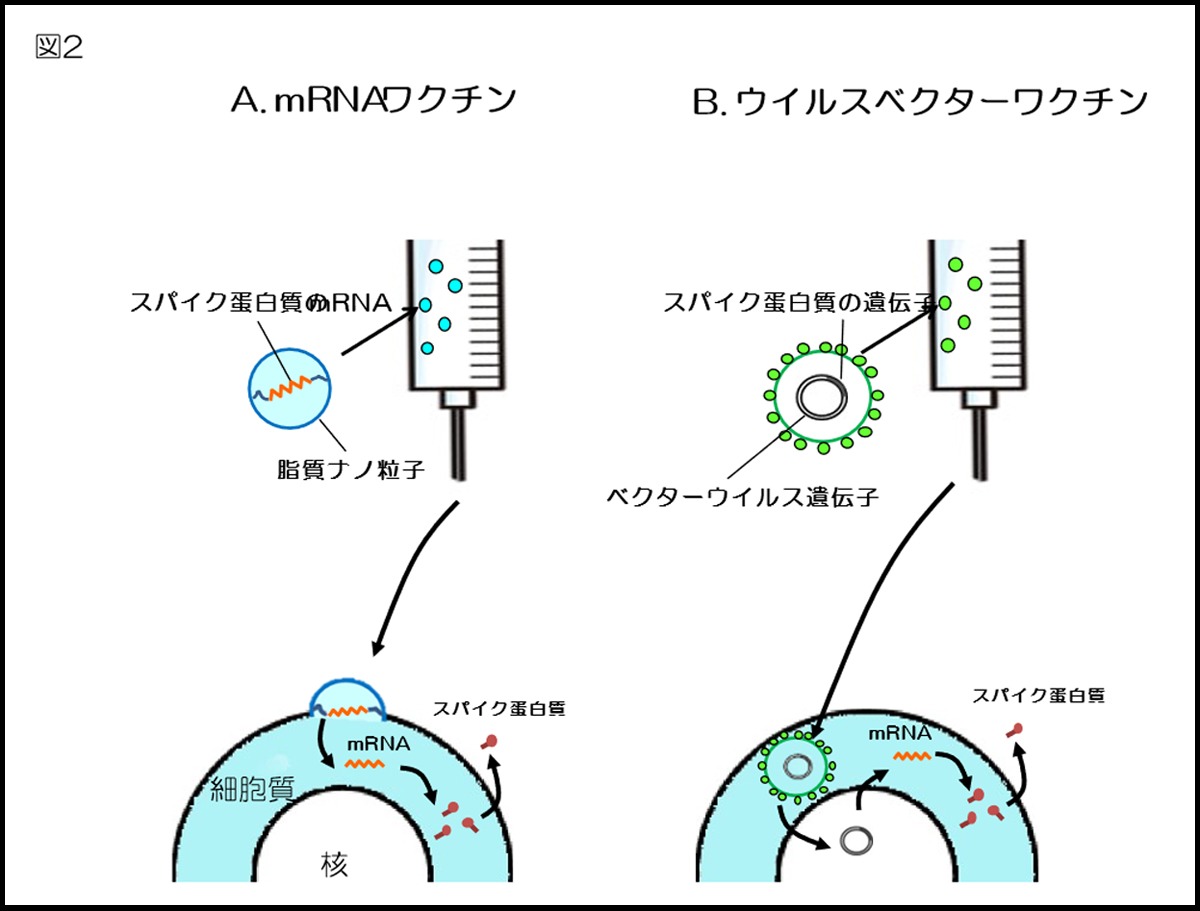
現在、ファイザー社およびモデルナ社が開発したmRNAワクチンが実用化されている。mRNAには容易に分解されるという問題点があるが、脂質ナノ粒子に格納することによって安定性が確保された。このワクチンが筋肉注射されると、スパイク遺伝子を持ったmRNAが筋肉細胞や樹状細胞に送り込まれる。mRNAをもとにスパイク蛋白質が細胞内で産生され、それが細胞外に放出される(図2A)。生成されたスパイク蛋白質の一部がリンパ球に提示され、免疫応答が起こる。また、mRNA 自体が自然免疫を刺激する働きもあり、免疫誘導を促進する4)。mRNAは細胞の細胞質に留まり、核内には入らないので、mRNAワクチンが人間の遺伝子に組み込まれることはない。
ファイザー社もモデルナ社のワクチンも3~4週間を空けた2回接種が必要である。ファイザー社のワクチンは有症状のCOVID-19の予防について、2回目接種後7日で95%の有効性を示した5,6)。基礎疾患のある65歳以上での有効性は91.7%であった。モデルナ社のワクチンの有症状のCOVID-19の予防での有効性は2回目接種後14日で94.1%であった7)。65歳以上では86.4%であった。これらのワクチンには超低温での保存が必要であるという問題がある。
ウイルスベクターワクチン
ウイルスベクターワクチンではアデノウイルスなどがベクター(運び屋)として使用されている。このウイルスベクターにスパイク蛋白質をコードする遺伝子を導入したものが、ワクチンとして利用されている。しかし、人間は成長する過程でアデノウイルスに感染しており、アデノウイルスに対する免疫を持っている。アデノウイルスを使用したウイルスベクターワクチンを接種しても、免疫によって破壊されてしまう。そのため、人間が殆ど経験していない動物由来のウイルスベクターを使用する必要がある。アストラゼネカ社のワクチンでは人体内で複製能力のないチンパンジーアデノウイルスが使用されている。
このワクチンが筋肉注射されると、スパイク遺伝子を持ったベクターウイルス遺伝子が細胞の核内に送り込まれる(宿主の遺伝子には組み込まれない)。そこで遺伝子情報がDNAからmRNAに転写され、mRNAをもとにスパイク蛋白質が細胞質内で産生される(図2B)。それが細胞外に放出され、その一部がリンパ球に提示されて、免疫応答が起こる。
アストラゼネカ社のワクチンの有効性は有症状のCOVID-19の予防効果については、2回目接種後14日で70.4%であった8)。ただし、1回目の接種量を減量することによって、90.0%となる可能性が報告されている。このワクチンは2~8℃で保管できる。
ワクチンの副反応
どのようなワクチンも副反応は付き物である。副反応が全くないワクチンは存在しない。新型コロナワクチンも例外ではなく、局所反応と全身反応がある。倦怠感、頭痛、筋肉痛、悪寒、注射部位の疼痛などが報告されているが、日常生活を妨げるようなことは殆どない。一般的に2回目接種後の方が1回目接種後よりも頻度が多く、症状が強いことが報告されている。アナフィラキシーが報告されているため、過去にアレルギーの既往のある人には十分な対応が必要である(禁忌ではない)。
【文献】
1.Honein MA, et al. Summary of guidance for public health strategies to address high levels of community transmission of SARS-CoV-2 and related deaths, December 2020
https://www.cdc.gov/mmwr/volumes/69/wr/pdfs/mm6949e2-H.pdf
2.Moghadas SM, et al. The implications of silent transmission for the control of COVID-19 outbreaks. Proc Natl Acad Sci U S A 2020;117:17513–5.
3.Lavezzo E, et al. Imperial College COVID-19 Response Team. Suppression of a SARS-CoV-2 outbreak in the Italian municipality of Vo’. Nature 2020;584:425–9.
4.日本感染症学会 ワクチン委員会 COVID-19 ワクチンに関する提言
https://www.kansensho.or.jp/uploads/files/guidelines/2012_covid_vaccine.pdf
5.FDA Briefing Document. Pfizer-BioNTech COVID-19 Vaccine. Vaccines and Related Biological Products Advisory Committee Meeting. December 10, 2020
https://www.fda.gov/media/144245/download (Accessed on January 05, 2021).
6.Polack FP, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med 2020; 383,2603-15
7.FDA Briefing Document. Moderna COVID-19 Vaccine.
https://www.fda.gov/media/144434/download (Accessed on January 05, 2021).
8.Voysey M, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet 2020.
DOI:https://doi.org/10.1016/S0140-6736(20)32661-1
#001 COVID-19の感染対策
#002 COVID-19の臨床症状、重症度、致死率
#003 COVID-19のCT所見と治療
#004 COVID-19の伝播するスピード
#005 SARS-CoV-2が環境表面に生息できる時間
#006 COVID-19の患者は発症前から感染性があるか?
#007 メンタルサポート
#008 自分の健康管理とサージカルマスク
#009 個人防護具の適切な着脱
#010 環境表面の清掃
#011 病室の空気と咳エチケット
#012 在宅感染対策の啓発
-----------------------------
矢野邦夫
浜松医療センター 副院長 兼 感染症内科部長
医学博士、浜松医科大学 臨床教授、産業医
1981年に名古屋大学医学部卒業。名古屋掖済会病院、名古屋第二赤十字病院、名古屋大学第一内科、米国フレッドハッチンソン癌研究所、浜松医療センターを経て米国ワシントン州立大学感染症科エイズ臨床短期留学。米国エイズトレーニングセンター臨床研修終了後、1997年に浜松医療センター感染症内科長、衛生管理室長に着任。2008年7月より同副院長(現職)。
インフェクションコントロールドクター、感染症専門医・指導医、抗菌化学療法指導医、血液専門医、日本輸血学会認定医、日本内科学会認定医、日本エイズ学会認定医・指導医、日本感染症学会、日本環境感染学会 評議員。
著書に、ねころんで読めるCDCガイドラインシリーズ、ねころんで読める抗菌薬シリーズ(メディカ出版)、エビデンスに基づいた抗菌薬適正使用マニュアル(メディカ出版)など多数。
▼ 指導ツール集 公開中 ▼

提供:INFECTION CONTROL
https://www.medica.co.jp/m/infectioncontrol/



